

























武汉封城、疫情防控一级响应、疫情数据每日通报、实施疫情联防联控工作机制、启动药械应急审批通道......自春节前全国打响抗“疫”阻击战以来,各级政府与部门便纷纷启动了各项应急机制,共同筑起了疫情防控的“高墙”。
远眺大洋彼岸的美国,同样经过诸多大规模传染性疾病等公共卫生事件。他们是如何应对重大公卫事件?FDA在其中又扮着演什么样的角色?他们的举措对中国抗“疫”有何启示?日前,美国汉佛莱医药顾问有限公司(JDB电子医药子公司)合伙人杜涛博士做客同写意线上直播间,讲述美国应对重大公卫事件的他山之石。
以下为杜涛博士演讲实录整理。

以抗击甲型H1N1流感为例,首先,FDA为缓解药品短缺的问题,允许发放已经通过了测试的过期批次的达菲。
其次,通过扩展处方指南,FDA将达菲的使用扩展到1周岁以下的儿童及症状持续超过2天的严重患者。
再者,FDA还放开了未获批药品的使用,例如通过EUA程序,FDA将尚处于临床研发阶段的帕拉米韦静脉注射液用于治疗临床疾患。
最后,FDA及时地进行信息公开,将所有发布的EUA挂网供公众阅览。
他山之石,可以攻玉。
在杜涛博士看来,FDA应对重大公卫事件政策措施对当下新冠病毒疫情来说有如下几点借鉴:
(1)积极监控供应链,联系医药和器械生产厂,确保医疗产品供应链的安全;和国际组织密切配合等;
(2)FDA调整了对海外产品合规性稽查和监控策略,如暂停对中国厂商的常规核查和临检;
(3)确保消费品安全,和美国海关配合检疫检查进口产品;
(4)对诊断、预防和治疗疾病的产品研发和使用给予大力支持;
(5)与多方合作,密切检测疫情进展。
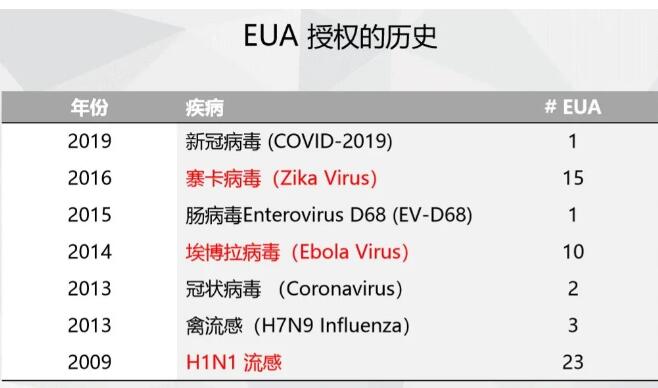
(1)甲型H1N1流感(H1N1-2009)
(2)、埃博拉出血热(Ebola-2014)
(3)、寨卡病毒病
(4)、新型冠状病毒(COVID-2019)

