此前,“袁来如此”专栏根据已发表的文献资料,对PK定量方法的设计作初步介绍(袁来如此 | 大分子生物分析概论(十四_上):LBA定量分析双特异性生物药的挑战)。本期将延续上期内容,重点就相关案例分析、复杂药物分子的未来生物分析技术以及前景等方面进行探讨。
“袁来如此”专栏系广州JDB电子医药微信公众号打造的科普学术专栏,内容均为JDB电子医药药物研究中心资深科学顾问袁智博士原创。
案例分析(Case studies)
以下案例研究是为了说明对于双特异性分子而言,生物分析的独特考虑,其适用于在药物开发的不同阶段设计和实施定量生物分析和PK评估。
案例分析1:在非临床研究中定量总和完整双特异性药物并评估ADA对PK的影响。
化合物X是一种基于支架的针对两种细胞因子的双特异性抗体。初步数据表明,这种特殊的支架产品平台可以在非临床物种中高频率地诱导免疫原性。为了更好地解释ADAs存在时的毒理学发现,生物分析小组决定开发两种不同的PK方法来测定动物血清中的总药物和完整药物的浓度。总PK方法是使用两种抗体对支架的框架进行分析。完整的PK方法是使用一种靶向细胞因子作为捕获试剂,另一种作为检测试剂。可以观察到,使用两种PK方法分析相同的样品产生的浓度与时间关系几乎完全等同,除了在较晚的时间点之外,药物浓度非常低的时候,即完整药物浓度略低于总药物浓度的时候。
在这些时间点观察到的低浓度差异只发生在少数受试者上。因此,ADA和生物转化(biotransformation)被认为是最可能的根本原因。需进行一项研究以确定这种差异的根本原因,如生物转化诱导的不稳定性,靶标干扰(target interference)和ADA干扰。为了验证这种双特异性分子的体内生物转化,例如,蛋白质水解是否揭示了影响稳定性的结构缺陷,故开发了两种配体结合质谱(ligand-binding mass spectrometry,LBMS)方法,使用抗人Fc免疫亲和捕获和靶目标捕获,然后进行分层次的质谱分析。采用与ESI-MS相结合的纳米级液相色谱法对非多种代谢产物进行了更高分辨率的分离和鉴定。
数据显示,生物转化的结果为阴性。ADA分析表明双特异性分子比其母体药物的ADA出现频率更高。尽管随后通过免疫原性表征,证实大多数ADAs并非中和性ADAs,但发现ADAs有助于快速地清除完整药物。这些数据也可以解释为当药物浓度足够低时,内源性细胞因子占据了特定的捕获/检测位点,即存在靶标干扰。结果表明,该药物在体内结构稳定。PK数据差异与完整药物的不稳定性无关,而更可能是由于ADAs高水平导致清除药物的速度更快。
案例分析2:一个F(ab’)2在体内生物转化为两个活性F(ab)单体的PK分析。
本案例研究涉及一个双特异性F(ab’)2,由一个anti-VEGF arm和一个anti-Ang2 arm组成,用于玻璃体内注射(intravitreal administration)治疗视网膜变性疾病,如湿性老年性黄斑变性和糖尿病性黄斑水肿。据报道,针对F(ab’)2抗体铰链区的,先前存在的内源性抗体(PEA)存在于很大比例的人群中。在未接受药物的食蟹猴和人血清样本中,都证实了这一点。移除这些预先存在的内源性抗体的铰链表位(hinge epitopes)使得该分子中只有单个二硫键将两个fab结合在一起。
因此,注射入玻璃体(其含有glutathione作为抗氧化产品的一部分,以保证晶状体的完整性)后,药物分子生物转化为individual Fabs,相关清除率(t1/2 <1天),通常比兔玻璃体的Fab (t1/2 约3天)或F(ab’)2 (t1/2 约3天)的清除率要大(未发表的观察结果)。
备注:一般情况下,t1/2与清除率的关系如下,即半衰期还取决于药物分布体积;如果假设分布体积恒定,则t1/2与清除率之间的关系是确定成反比的:

因此,完整的F(ab’)2和individual Fab碎片均存在于眼腔(玻璃体和水相之中)和系统循环之中。正如所预料的,啮齿类动物脉络膜新生血管模型(rodent choroidal neovascularization models)显示,individual Fabs保留了生物活性。为了全面地描述活性药物暴露量的特征,有必要定量这3种药物形式。因此,开发并验证了3种单独的PK定量方法。此前有学者曾经考虑过使用一种总PK定量方法来测定所有这3种形式。但是,该分子是一个新颖结构,故有必要阐明其生物转化的动力学,这对于描述该分子体内的行为是很重要的。
定量完整待测物的ELISA方法使用固定的(immobilized)重组蛋白Ang2捕获待测物,然后加入biotin-VEGF,最后加入streptavidin-HRP,是一个sequential sandwich格式。外加待测物的回收率实验证明这种测试格式仅能够特异性地检测F(ab’)2,但检测不到两种Fab分子中的任何一个。定量两个Fab分子的方法都采纳类似的基本格式:使用各自的靶标-Ang2或靶标-VEGF,从样本中捕获Fabs。然后加入biotin-sheep antihuman IgG的重链和轻链(H&L),最后,加入streptavidin-HRP进行检测。
值得注意的是,采用测定Fab的格式,也可以检测到完整分子。尽管使用Fabs作为标准品(standards)和对照品(controls),在分析Fab时,也定量了完整F(ab’)2。此外,使用F(ab’)2和任何一个Fab的混合物,可以通过从完整分子(高特异性)的定量结果中减去Fab结果来定量另一个Fab。已经验证了所有这些分析方法,并用于兔血清样本的非临床研究,也认证了这些方法可用于食蟹猴的血清和水/玻璃体/视网膜的萃取物中药物的定量。血清定量分析的另一个挑战是几个ng/ml甚至更低的药物浓度,这也是玻璃体腔生物药给药的一致特点:给药量很小(通常是<1 mg/eye);药物在到达系统循环时,经历了高倍数的稀释。
案例分析3:在非临床研究中监测体内双特异性药物生物转化的总和活性(total and active)药物的定量。
一个针对肿瘤适应症的双特异性单克隆抗体靶向两个细胞表面的抗原,其药理作用取决于单克隆抗体的两个结合臂(both binding arms)的完整。然而,在体外生物物理表征过程中,在其中一个结合臂中发现了翻译后修饰(post-translational modification,PTM)的问题。但这种PTM,不能在不显著损害生物活性的情况下,通过蛋白质工程而排除,因为在不稳定的氨基酸上的点突变(point mutation)会完全破坏单抗与靶标的结合。此外,仅具有第二个结合臂功能的药物变异体的累积,可能会屏蔽活性药物结合第二个靶点,并可能在多次给药后诱发毒性反应。
对该单抗体内生物转化的特征进行研究是势在必行的,如转化的动力学和程度,这可以为进一步开发该单抗提供指导。随后,使用与分子的Fc部分特异性结合的测试试剂开发了一个桥接格式的总药物PK定量方法,辅之以一种活性药物PK定量方法:即使用靶标蛋白作为PTM-liable functional domain的捕获试剂,使用抗人Fc试剂作为检测试剂。利用野生型和拥有点突变的药物的混合比例,活性PK方法,在总药物存在的情况下,能够区分和准确测定活性药物的百分比。之后,评估了该药物分子在食蟹猴上的PK特性。使用了总和活性PK定量方法来测定研究样本中总和活性药物的浓度。实验数据证实,体内样品中的药物出现了PTM,并且活性药物浓度百分比随时间而降低。基于建模和仿真,可以在临床研究中减少剂量间隔来减轻活性药物浓度的降低。非临床研究结果有助于决定使用活性PK定量方法作为支持临床研究的主要方法。而在FIH研究中,总PK定量方法可用于进一步描述无活性药物变异体(inactive drug variants)潜在的累积及其对PK/PD和毒性的影响。
复杂药物分子的未来生物分析技术
如表1中所总结的,一般需要多种PK定量方法和ADA方法评估ADC和双特异性抗体的基础药代动力学和免疫原性。分析方法数量的增加给样本的收集、储存、运输、分析和分析方法的生命周期管理带来了巨大的负担。在某些情况下,由于样本数量有限,根本不可能进行多次分析。对于增加的功能域和潜在的生物转化,仅仅增加分析方法的数量以满足生物分析需求似乎是一个直接的解决方案,但“两点式two-point”结合方法(如夹心式LBA)并不适合评估具有多域(>3)构造的分子“完整性intactness”。尽管免疫捕获(IC-)-LC-MS/MS方法在理论上可以识别来自多个功能域的特征肽,但有关“完整性”和功能的信息仍然缺失。因此,随着复杂药物模式(complex drug modalities)的生物转化越来越受到的关注,定量LBA方法和(IC-)LC-MS/MS方法往往无法对潜在的生物转化提供相关信息。正如CovX-Body和基于框架(scaffold-based)的双特异性抗体的案例所表明的那样,PK行为的意外不一致触发了潜在生物转化的嫌疑,进而就需要新的分析方法来进一步研究。
表1.ADC和双特异性抗体的PK定量方法(SCR,标准曲线范围;ECL,电化学发光;N.A.,不适用)
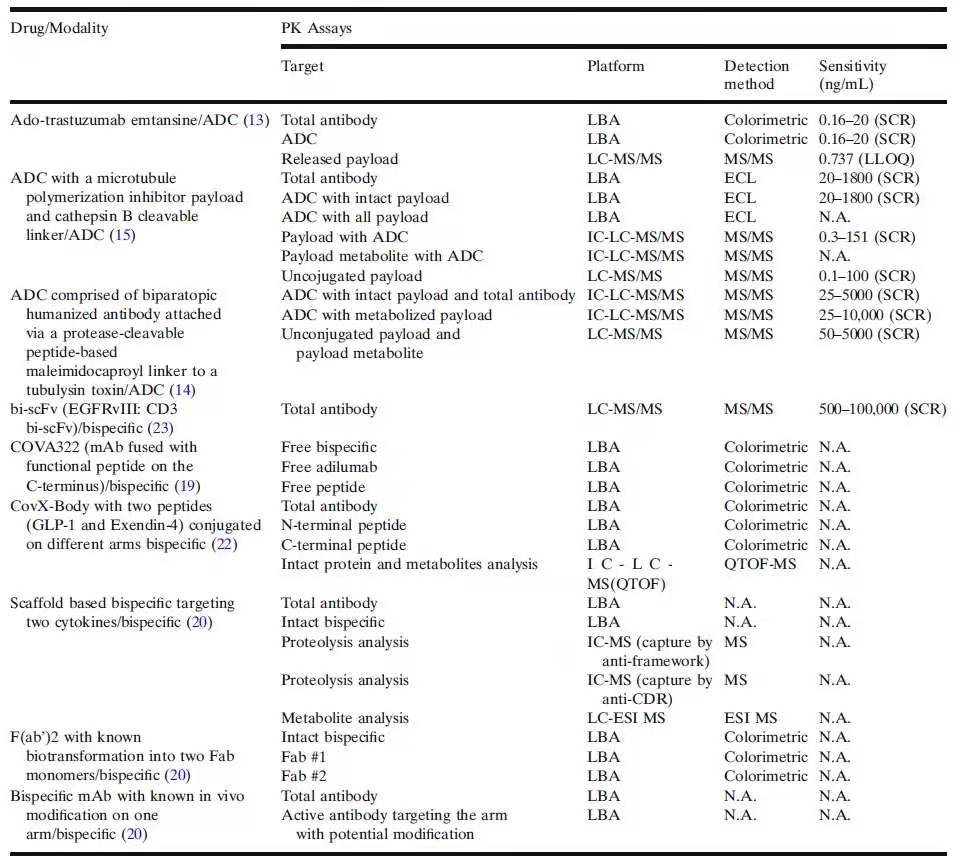 备注:表格中参考文献的标注不适用。
因此,使用multiplexed PK/ADA方法以测定完整药物、各种变构体(variants)和相关的ADA是非常需要的,同时,也对潜在的生物转化提供相关信息。Multiplexed检测方法已在联合疗法中有早期应用,但尚未看到对复杂药物模式“biotransformation ready”的multiplexed测试方法,用以帮助评估复杂药物的完整性,表征各种生物转化,并测试对药物/药物变构体各部分的免疫反应。下文将简单介绍对复杂药物模式有希望的两项生物分析技术:HR-MS定量分析完整蛋白质和毛细管Western Blot定量分析。
HR-MS 定量分析完整蛋白质
备注:表格中参考文献的标注不适用。
因此,使用multiplexed PK/ADA方法以测定完整药物、各种变构体(variants)和相关的ADA是非常需要的,同时,也对潜在的生物转化提供相关信息。Multiplexed检测方法已在联合疗法中有早期应用,但尚未看到对复杂药物模式“biotransformation ready”的multiplexed测试方法,用以帮助评估复杂药物的完整性,表征各种生物转化,并测试对药物/药物变构体各部分的免疫反应。下文将简单介绍对复杂药物模式有希望的两项生物分析技术:HR-MS定量分析完整蛋白质和毛细管Western Blot定量分析。
HR-MS 定量分析完整蛋白质
与针对完整药物分子中某个选定区域的LBA和LC-MS/MS技术相比,完整蛋白质的定量分析旨在将一个复杂的药物分子作为一个整体来研究,这能够揭示重要的高层次结构和生物转化的相关信息。完整蛋白的LC-MS分析通常用作对生物转化研究的定性分析。Murphy等人使用IC-LC Q-ToF MS,在CovX-Body双特异性抗体上发现并鉴别了蛋白酶剪切掉的含有8个氨基酸的肽段。He等人利用高分辨率的QTOF-MS与IC-LC相结合,成功地在小鼠血浆中,鉴别了若干不同DARs的ADC和生物转化了的变异体(biotransformed variants,由于增加/删除了hexose, glutathione, cysteine以及linker-drug)。近年来,HR-MS在灵敏度和质量分辨率方面的提高,逐渐使其在定量生物分析中得以有更广泛的应用。
Jian等人建立了IC-LC-QTOF-MS的工作流程,用于小鼠血浆中人类mAbs的绝对定量。定量的下限(LLOQ)为1000ng/mL(20 L血浆样品),并可降至250ng/mL,如果使用200L样品。在优化其数据处理策略后,LLOQ降至50ng/mL。使用所述工作流程,Jian等人随后展示了GLP1-Fc融合蛋白的定量;同时,在对小鼠的研究过程中,识别了该药物的两种主要蛋白酶降解产物。
Lanshoeft等人验证了基于multiplex IC-LC-HRMS的PK定量方法,并用于非临床PK研究,该方法同时定量分析了大鼠血清中两个人类IgG1。类似地,Jin等人在大鼠血清中定量了完整的trastuzumab emtansine(一种ADC)及其主要的DAR物种,其定量下限值约为20ng/mL,线性动态范围为5-100g/mL。
另一个有趣的应用是最近Zhang等人报道的,在非变性LC条件下对native intact mAb进行的定量分析,这可能为使用LC-HR-MS技术以multiplex的方式建立结合(bound)/未结合(unbound)PK定量方法以及其它各种功能域PK的定量方法提供了机会。
毛细管Western Blot定量分析方法
毛细管Western blot,也称为毛细管纳米免疫测定(capillary nanoimmunoassay,CNIA),已由制造商Protein Simple(San Jose, CA)商业化的Simple Western system,是指毛细管电泳免疫测定系统,它提供基于蛋白质大小和电荷的分离格式。与在分离和检测之前进行配体结合的IC-LC-MS技术不同,Western blot首先分离蛋白质,然后使用配体结合作为检测方法。因此,它能够使用multiplexed immunoassay,同时检测完整的蛋白质及其生物转化的产物,并对变异的各种功能域进行表征。
目前,毛细管Western Blot定量分析在蛋白质药物的PK研究中应用仍然有限。Li等人在小鼠研究中验证了无浓缩的PK方法,以定量小鼠血浆中的polyhistidine N-和FLAG C-terminally-tagged重组蛋白(约55kDa),其LLOQ为20ng/mL。Anti-FLAG tag抗体在immunoblot步骤中用作初级抗体。研究发现,只需以1:100至1:500的比例稀释样品,即可消除基质中高丰度蛋白的干扰。
此外,Kodani等人使用capillary western blot检测到丙型肝炎病毒(HCV)的IgG抗体,表明其在抗药物抗体(ADA)检测方面的潜在应用。重组HCV蛋白首先在毛细管中分离和固定。稀释的人类血清随后在毛细管中孵育,使抗HCV抗体与固定的抗原结合。这一步骤之后,使用抗人类IgG-HRP抗体再进行第二次孵育。在70个特表征良好的人血清样本的检测中,该方法与另一种市售的抗HCV抗体测试方法的相关性良好。
结论
为了解决双特异性分子开发过程中所需的生物分析支持,本文讨论了在开发这些药物分子的PK分析策略时一些独特的考虑。本文提出的策略和方法可以应用于双特异性分子和其它多域大分子药物,这需要对特定的药物分子其作用机制(MOA)和潜在的靶标生物学,以及评估PK/PD的所需要的数据有全面的了解。
大分子生物分析行业需要新的定量分析技术来开发multiplexed PK定量方法,以便定量复杂模式的药物及其生物转化产物。用于完整蛋白质分析的(IC-)LC-HR-MS和capillary Western blot技术拥有很大应用前景,因其multiplexibility和提供目标待测物的多维信息(如分子量等电点和域功能/domain functionality)的能力。在过去几年中, HR-MS和capillary Western blot platforms的定量灵敏度有了显著改善,尽管这些技术仍需要进一步改善,以获得更广泛的接受。当前HR-MS系统的一般操作相对简单,但HR-MS(以及capillary Western blot)的数据分析、解释和验证,从监管的角度看,还需要进一步明确。
从理想的和雄心勃勃的角度思考,最好将PK/PD/免疫原性/生物转化的生物分析整合到一个分析测试方法之中,以减少药物开发所需的资源,并促进在同一组患者样本中全面阐明药物的PK/PD行为。设计和开发这样的定量分析的方法,对每一种生物药结构都是独特的,需要一种彻底的“适合其用途”的方法及其确认(confirmation)。为双(多)特异性分子开发可靠、稳健和可重现的PK分析方法是非常具有挑战性的,因为多种因素会影响准确(accurate)而有意义(meaningful)的浓度测定值。未来生物分析行业和监管机构对指导定量分析这些高度复杂的生物(蛋白)药的最佳做法的讨论和意见,将会极具价值。
未来前景
随着生物分析方法的特异性、选择性和灵敏度的不断提高,更准确(accurate)和更精密(precise)的测定双特异性抗体浓度和评估其在生物样品中的免疫原性将成为可能。预计双特异性和多特异性生物药的数量和种类将继续扩大,这将促进新的生物分析方法的开发,以适应这些分子的结构复杂性和MOAs。
当然,目前的方法将被用于新的蛋白药物的定量。尽管LBA方法是目前生物分析方法的首要选择,并且在可以预见的未来仍将如此,LC-MS/MS方法,由于其与生俱来的multiplexed的定量分析能力,可能会得到更加广泛地应用,以支持双特异性生物药的PK评估。LC-MS/MS比LBA分析具有更少的分析变异性(variability)和关键试剂的可及性(availability)问题。预期分析实验室的自动化将扩展到生物分析的所有阶段,以减少人工错误和提高数据质量。
特别声明
本文如有疏漏和误读相关指南和数据的地方,请读者评论和指正。所有引用的原始信息和资料均来自已经发表学术期刊、官方网络报道等公开渠道, 不涉及任何保密信息。参考文献的选择考虑到多样化但也不可能完备。欢迎读者提供有价值的文献及其评估。
参 考 文 献
1.Zhu, L, et al. (2020). "Bioanalytical Challenges in Support of Complex Modalities of Antibody-Based Therapeutics." AAPS J 22(6): 130.
2.Ma, M., et al. (2019). "Bioanalytical challenges and unique considerations to support pharmacokinetic characterization of bispecific biotherapeutics." Bioanalysis 11(5): 427-435.
3.Seimetz D. Novel monoclonal antibodies for cancer treatment: the trifunctional antibody catumaxomab (removab). J. Cancer 2, 309–316 (2011).
4.Mullard A. Bispecific antibody pipeline moves beyond oncology. Nat. Rev. Drug Discov. 16(11), 666–668 (2017).
5.Diao L, Meibohm B. Tools for predicting the PK/PD of therapeutic proteins. Expert Opin. Drug Metab. Toxicol. 11(7), 1115–1125 (2015).
6.Trivedi A, et al. Clinical pharmacology and translational aspects of bispecific antibodies. Clin. Transl. Sci. 10(3), 147–162 (2017).
7.Ezan E, et al. Assessment of the metabolism of therapeutic proteins and antibodies. Expert Opin. Drug Metab. Toxicol.10(8), 1079–1091 (2014).
8.Fischer SK, et al. The assay design used for measurement of therapeutic antibody concentrations can affect pharmacokinetic parameters. Case studies. MAbs 4(5), 623–631 (2012).
9.Ruf P, et al. Pharmacokinetics, immunogenicity and bioactivity of the therapeutic antibody catumaxomab intraperitoneally administered to cancer patients. Br. J. Clin. Pharmacol. 69(6), 617–625 (2010).
10.Samineni D, et al. Impact of shed/soluble targets on the PK/PD of approved therapeutic monoclonal antibodies. Exp. Rev. Clin. Pharm. 9(12), 1557–1569 (2016).
11.Villegas VM, et al. Current advances in the treatment of neovascular age-related macular degeneration. Expert Opin. Drug Deliv. 14(2), 273–282 (2017).
12.Ruppel J, et al. Preexisting antibodies to an F(ab’)2 antibody therapeutic and novel method for immunogenicity assessment. J. Immunol. Res. 2016, 1–8 (2016).
13.Fan X, et al. Lens glutathione homeostasis: discrepancies and gaps in knowledge standing in the way of novel therapeutic approaches. Exp. Eye Res. 156, 103–111 (2017).
14.Kang L, et al. LC-MS bioanalysis of intact proteins and peptides. Biomed Chromatogr. 2020;34(1):e4633. https://doi.org/10.1002/bmc.4633.
15.Chen, J, et al. "Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics." Journal of translational medicine 13: 182. (2015)
16.Murphy RE, et al. Combined use of immunoassay and twodimensional liquid chromatography mass spectrometry for the detection and identification of metabolites from biotherapeutic pharmacokinetic samples. J Pharmaceut Biomed.2010;53(3):221–7. https://doi.org/10.1016/j.jpba.2010.04.028.
17.He JT, et al. High resolution accurate-mass mass spectrometry enabling in-depth characterization of in vivo biotransformations for intact antibody-drug conjugates. Anal Chem. 2017;89(10):5476–83.https://doi.org/10.1021/acs.analchem.7b00408.
18.Jian WY, et al. A workflow for absolute quantitation of large therapeutic proteins in biological samples at intact level using LC-HRMS. Bioanalysis.2016;8(16):1679–91. https://doi.org/10.4155/bio-2016-0096.
19.Lanshoeft C, et al. Generic hybrid ligand binding assay liquid chromatography high resolution mass spectrometry based workflow for multiplexed human immunoglobulin G1 quantification at the intact protein level: application to preclinical pharmacokinetic studies. Anal Chem. 2017;89(4):2628–35. https://doi.org/10.1021/acs.analchem.6b04997.
20.Jin W, et al. LC-HRMS quantitation of intact antibody drug conjugate trastuzumab emtansine from rat plasma. Bioanalysis. 2018;10(11):851–62. https://doi.org/10.4155/bio-2018-0003.
21.Zhang LY, et al. Top-down LC-MS quantitation of intact denatured and native monoclonal antibodies in biological samples. Bioanalysis. 2018;10(13):1039–54. https://doi.org/10.4155/bio-2017-0282.
22.Li Y, et al. An efficient and quantitative assay for epitope-tagged therapeutic protein development with a capillary western system. Bioanalysis. 2019;11(6):471–84. https://doi.org/10.4155/bio-2018-0248.
23.Kodani M, et al. An automated immunoblot method for detection of IgG antibodies to hepatitis C virus: a potential supplemental antibody confirmatory assay. J Clin Microbiol. 2019;57(3). https://doi.org/10.1128/JCM.01567-18.
关于JDB电子医药 临床研究服务:
JDB电子医药拥有一支规模庞大、专业成熟的临床研究队伍,可提供包括医学、项目管理、监查、稽查、数据管理和统计分析、生物样本检测在内的临床试验全流程解决方案。截至2020年,JDB电子医药服务的客户超1000家,完成800多项临床试验项目,助力客户获得新药证书60多项、生产批件超过80项。拥有丰富的临床试验服务经验,服务项目涵盖临床研究各个领域,在肿瘤、肝病、消化等创新药领域拥有独特的临床服务体系。
JDB电子医药在全国设有40多个临床监查网点,与全国近600个临床试验机构展开合作,并运用ORACLE OC/RDC及CTMS系统,控制临床数据采集的及时性、管理临床试验过程的规范性。





























