

























 公司新闻
公司新闻

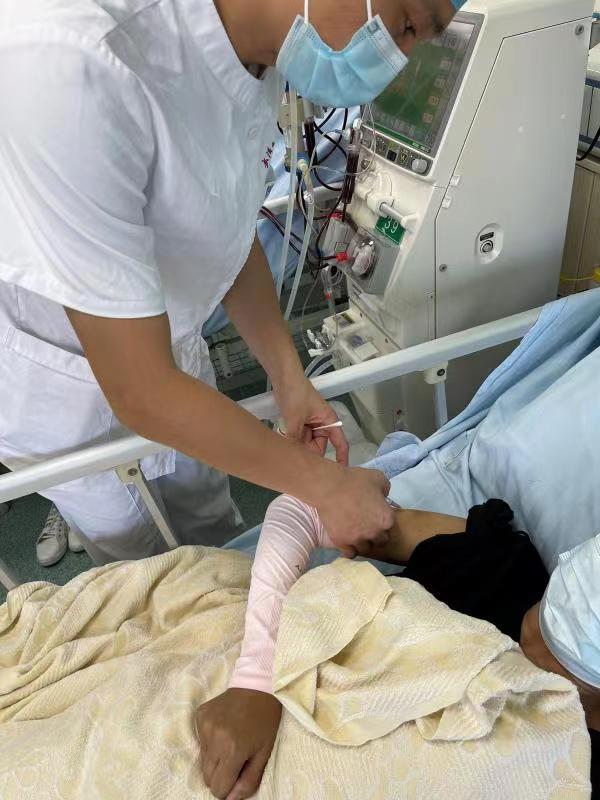
今天(6月15日),rhEPO-FcⅠb/Ⅱ期临床试验(下称rhEPO-Fc项目)首例受试者在武汉大学中南医院正式入组。 首批受试者入组标志着rhEPO-Fc项目正式进入Ⅰb/Ⅱ期临床试验阶段。rhEPO-Fc是申办方自主研发的治疗用1类生物制品,JDB电子医药为其Ⅰb/Ⅱ期临床试验提供全程CRO服务。 JDB电子医药相关负责人表示,本次入组的首例受试者为肾性贫血患者,受试者入组后将注射rhEPO-Fc项目试验药物,并在后续12周内完成多次给药、检查等。 “首例受试者入组是本临床试验的开始,我们将重点关注受试者在注射rhEPO-Fc项目试验药物后在临床过程中的有效性、安全性和耐受性。”如果试验顺利,后续将陆续启动多家研究中心,助力rhEPO-FcⅠb/Ⅱ期临床研究全面提速。 据介绍,rhEPO-Fc项目是一款利用基因治疗技术研发治疗肾性贫血的新药,在临床前研究和前期临床试验中展现出了良好的安全性和有效性,具有良好的临床应用前景,有望成为治疗慢性肾脏病透析患者肾性贫血的新选择。该项目于上周五召开启动会,3个工作日便完成首例入组。 关于JDB电子医药:新药&医疗器械一站式综合服务CRO JDB电子医药科技股份有限公司(简称“JDB电子医药”, 股票代码为300404)创建于2002年,2015年在深圳创业板上市,注册资本金2.61亿元,是一家为国内外医药企业提供药品、医疗器械研发与生产全流程“一站式”外包服务(CRO+CDMO)的新型高新技术企业。公司拥有5.1万平方米的现代化办公、实验和生产场所,目前有超1000名员工,旗下拥有二十多家全资、控股子公司以及十余家关联业务的参股公司;目前获得中国医药外包公司10强、广州市科技小巨人企业、广东省诚信示范企业、广州市著名商标、中国最具投资价值企业50强、中国医药质量管理协会CRO分会会长单位等荣誉称号;是国内仅有的两家全流程服务CRO之一,也是以临床试验为主要业务的CRO上市公司之一。 JDB电子医药“一站式”服务包括:新药立项研究和活性筛选、药学研究(原料、制剂)、药物评价(药效学、毒理学)、小分子创新药一体化服务、临床研究、中美双报(注册服务)、CDMO生产(MAH落地)、技术成果转化等,涵盖了新药研发各个阶段。
2022-06-16
今天(6月10日),rhEPO-FcⅠb/Ⅱ期临床试验(下称rhEPO-Fc项目)启动会以线上形式在武汉、北京、广州、东莞同时举行。 rhEPO-Fc项目是由申办方开发的治疗用1类生物制品,武汉大学中南医院肾内科副主任水华担任该项目PI,JDB电子医药为该项目提供Ⅰb/Ⅱ期临床研究服务。 武汉大学中南医院肾内科主任吴小燕、副主任水华、临床试验中心秘书吴建元以及申办方和JDB电子医药有关负责人参加此次会议。本次会议由吴建元主持。会议伊始,吴小燕教授代表科室发表讲话。她表示,rhEPO-Fc项目是一款利用基因治疗技术研发治疗肾性贫血的新药,在临床前研究和前期临床试验中中展现出了良好的安全性和有效性,具有良好的临床应用前景,有望成为治疗慢性肾脏病的新选择。经过前期多轮会议探讨,目前已对研究的整体策划、临床试验方案等板块进行了充分论证,希望在各方的共同努力下,保质保量快速推进该项目的Ⅰb/Ⅱ期临床试验,为该项目后续研究打下坚实的基础。随后,JDB电子医药CRA曹淼琴就该项目研究背景、试验方案、试验流程、药物配制、给药操作、给药标准、试验过程中的特别注意事项等进行了汇报,并介绍生物样本预处理注意要点、环境生物安全风险控制计划等注意事项。 申办方代表对武汉大学中南医院和JDB电子医药的支持和帮助表示感谢,后续将全力支持和配合临床试验方面的各项工作,相信在各方的共同努力下项目将取得理想的成果。 会议尾声,水华教授作总结发言。她表示,项目的前期准备工作详实到位,为项目的启动奠定了良好的基础,目前该项目的受试者招募较为顺利,部分受试者已经做好入组准备,相信在医疗机构、申办方、CRO等各方的共同协作下,一定会科学、严谨地完成好本项试验工作,令rhEPO-Fc项目能够早日应用于临床,造福人类生命健康。 JDB电子医药相关负责人表示,rhEPO-Fc项目各项准备工作进展顺利,预计首批受试者于下周入组。
2022-06-10
昨天(6月1日),第二届福田生物医药创新论坛在深圳福朋喜来登大酒店隆重举行。 本次论坛由广东省生物医药创新技术协会主办,JDB电子医药子公司深圳博瑞承办,旨在汇聚粤港澳大湾区创新药研发不同领域专家学者,探讨创新药领域最新进展,为大湾区生物医药发展建言献策,共商契机,畅谈未来。 广东省药监局一级巡视员苏盛锋,国家药监局药品审评检查大湾区分中心主任黄晓龙,广东省药监局药品安全总监、产业促进办主任叶永才,产业促进办二级巡视员罗卓雅,审评认证中心党委书记、主任曾祥卫,化妆品监督管理处副处长任杰,药品监管科学学会筹备组常务副组长蔡高斯,广东省生物医药创新技术协会执行会长朱少璇,河套深港科技创新合作区创新局代表周雅,河套深港科技创新合作区事务署研究员梁志鹏,深圳市发改委创新中心生物与健康产业中心主任王春安,原CDE生物制品临床部审评员万志红,中山大学(深圳)药学院院长邓文斌,深圳市人民医院转化医学协同创新中心主任李富荣,北京大学深圳医院肿瘤科主任王树滨,深圳普瑞金生物药业股份有限公司首席技术官张继帅,德勤中国资本市场服务部华南区上市服务合伙人黄玥,广东华南新药创制中心首席科学家张克坚,广州市恒诺康医药科技有限公司董事长张健存,深圳翰宇药业股份有限公司执行总裁余品香,JDB电子医药董事长王廷春,副总经理、深圳博瑞总经理左联,JDB电子医药子公司美国汉佛莱法规部高级副总裁陈谨等近200名来自政界、学术界、企业界的专家学者共襄此次盛会。 会议伊始,苏盛锋、黄晓龙、朱少璇代表广东省药监局、国家药品监督管理局药品审评检查大湾区和主办方发表致辞。 苏盛锋在致辞中向与会专家学者介绍了当前国家稳住经济大盘的现实背景,阐述了广东省鼓励生物医药产业发展各项具体政策。他表示,当前是生物医药产业发展的黄金时代,产业链各主体要力图成为不负时代的开创者、践行者,实现精诚合作,良性互动,不断激发行业的内生动力。希望通此次会议深圳不断加快产学研的融合发展,完善创新药的全产业链建设,成为引领大湾区和广东省生物医药产业创新发展的标杆,推动全省的生物医药产业高质量发展。 黄晓龙表示,国家药品监督管理局药品审评检查大湾区分中心成立于2020年12月,是国家药监局贯彻落实党中央、国务院在粤港澳大湾区推进更高起点深化改革和更高层次对外开放等战略部署和发展规划的重要举措。在不到1年半的时间,大湾区分中心与部分本土生物医药企业进行交流,但显然是远远不够的。希望通过此次会议,大湾区分中心能进一步了解大湾区生物医药产业各主体发展需求,为大湾区的生物医药产业高质量发展作出应有的贡献。 朱少璇则以时下细胞治疗的行业热点切入,直面广东省在生物医药产业领域的发展短板,并向与会者抛出了创新药发展如何破局,如何弯道超车的话题。她表示,近段时间以来,从中央到省发布了多个针对于生物医药产业发展的利好新政,相信在政府、企业、资本、技术、人才等资源不断汇聚下,广东省生物医药产业的未来定会迎来大发展的新时代。时下正值六一国际儿童节,朱少璇勉励创新药产业的从业者们保持如孩童般那颗不断探索、不断求知的初心,共同绘就创新药高质量发展的宏伟画卷。 随后,王春安博士便以《深圳市生物医药与健康产业发展情况及政策分享》展开了演讲,正式为这场行业盛宴拉开了序幕。 演讲伊始,王春安博士就向与会者从生物医药产业定义变迁、国内外发展现状、深圳发展基础等方面介绍了深圳生物医药产业发展的现状,同时就深圳当前的生物医药产业扶持政策进行了解读,并就相关政策与长三角、京津冀等地进行了对比。随后,他围绕着技术、政策、产业环境等方面发展优势对深圳生物医药产业的未来进行了展望。 万志红博士作为原CDE生物制品临床部审评员,对生物制品相关临床政策、法规颇为熟稔。在论坛上,她对《免疫细胞治疗产品临床技术指导原则》的重点内容作了详细解读。 “近些年国内细胞和基因治疗领域的发展虽如火如荼,但有些品种的IND申报后却并未获批临床。主要是由于药学研究不符合要求、非临床研究不完善或安全性风险较大所致。”万志红博士一针见血地指出问题的根源。 在她看来,探索性临床要考虑给药间隔,以充分观察细胞回输后的不良反应情况。确证性临床试验要能充分说明药物的有效性和安全性,安全性分析集应足够大。根据产品的性质差异,应进行1-15年的随访。 邓文斌教授是干细胞领域资深专家,他以《干细胞与神经系统药物研究:机遇与挑战》为题向与会者分享了他及其团队在该领域潜心研究的成果。 “通过诱导性多潜能干细胞(iPSC)技术,可进行细胞、器官、动物层面的造模,将iPS细胞分化,又可进行细胞治疗。”邓文斌教授详细介绍了iPSC向星形胶质细胞、少突胶质细胞、小胶质细胞分化的研究工作,并在动物模型上证明了其治疗作用。 “我们的研究还出了一个干细胞产品“Olig2-OPC”和一个干细胞药物“WIN55212-2”将间充质干细胞诱导为神经胶质前体细胞(MSC-OPC),在神经系统疾病治疗领域有着广阔的应用空间”。 李富荣博士则在演讲中着眼于干细胞技术的落地。在他眼中,影响干细胞技术发展的既有生产场地、试剂、SOP这类外在因素,也有供体差异、组织来源异质性等生物学因素。“干细胞作用机制复杂,它可能是世界上最复杂的药物,在干细胞药物研究领域,我们还有很多问题亟需找到答案,这既不是一朝一夕的事情,也不是一个人两个人的事情,这需要整个产业的共同参与,进而攻坚克难,做大做强。” 作为临床一线的专家,王树滨教授的演讲颇为引人关注。他以《中国创新药物改变中国肿瘤临床实践》为题,分享自己在抗肿瘤领域的真知灼见。 王树滨教授在其演讲中就中国创新抗癌药物研发、中国肿瘤临床试验发展、中国肿瘤临床实践规范、肿瘤新药医保政策推进等方面阐述了自己的观点,并分析了中国肿瘤创新药的历史变迁、发展路径以及未来展望。 在他看来,中国原研药发展,改变了中国肿瘤的临床实践,提高了中国肿瘤患者的治疗效果,增加了药物的可及性,使患者受益,促进了中国生物医药产业的快速发展。同时,中国原研药物研发处于快速发展期,需要不断完善能力、队伍方面建设,推动产业高质量发展。 JDB电子医药子公司美国汉佛莱在中美双报方面有着丰富的经验,陈谨博士作为汉佛莱的首席顾问,分享了CAR-T新药的中美双报策略。 “CAR-T药物的IND申报要有充分的药学(CMC)研究,确保产品的安全性,目前有快速通道、突破性疗法、优先审核、加速审批、再生医学先进疗法五种通道可加快药物临床或上市的批准,其中再生医学先进疗法(RMAT)是专为CAR-T类再生医学药物而设立的,其相对常见的突破性疗法认定更具优势。”陈谨博士说,“近年来美国汉佛莱在先进疗法领域申报的品种数在逐年递增,在2021年全公司业务占比以超过40%,与国内外诸多知名医药公司开展了合作。” 作为在场唯一的资本市场代表,黄玥以《资本市场如何赋能创新药发展》为题,向与会者分享了当前资本市场对生物医药产业的观感。她表示,当前的生物医药产业正在经历着冰火两重天的局面,一厢是生物医药企业纷纷实现上市,去年创下了19家生物医药企业上市的新高,另一厢却是诸多生物医药企业上市跌破发行价。 “企业要想获得资本的助力,黄金法则就是做好自己以及门当户对。做好自己就是企业要做好内部控制,要把自身在财务、审计、税务等方面工作交由专业人士来操作。门当户对则是要选择适合的资本,要选择对产业了解,对企业有信心,对公司前景充满希望的资本公司进行合作,而不是为了快速发展,打破企业成长节奏,盲目与资本公司产生联系,甚至选择对赌等风险较大的方式进行合作。” 张继帅博士以《靶向BCMA的CAR-T药物开发》向与会者详细介绍了靶向BCMA的CAR-T药物(PRG1801)的开发过程。不同于传统的CAR-T药物,PRG1801用的是纳米抗体,这使它避免了传统CAR-T药物容易错配和聚集,从而实现CAR-T细胞不被过分耗竭。“PRG1801在动物体内显示出优秀的抗肿瘤效果,目前已处于一期临床研究阶段,其有效性和安全性数据均优于多个同类品种,后续将优化临床和商业化方案,争取早日造福多发性骨髓瘤患者。”论坛期间,深圳博瑞还举行了“深圳福田生物医药项目评估交易中心”揭牌仪式。该中心将致力于公益性、免费性项目评估、对接、转化,进一步激活生物医药项目潜在价值,激发资本市场对生物医药项目的关注活力,充实生物医药企业项目管线,助力生物医药项目持续高效发展。 在整个论坛最后的圆桌讨论环节,朱少璇、李富荣、张克坚、张健存、余品香、黄玥、张继帅等大咖悉数登场,共同围绕《红利时代,创新药如何破局》这一话题展开探讨。 讨论中,干细胞发展困境与应用前景,细胞治疗相关疗法和药物的监管发展,小分子药物、核酸药物、细胞治疗药物的前景对比,多肽药物抗肿瘤趋势,初创公司如何受到资本关注都成为了讨论的焦点内容,各位嘉宾不吝言辞,各抒己见,气氛颇为热烈,引发了会场多次掌声。 整场论坛一直持续到当晚近7点,论坛结束后,众多现场观众意犹未尽,纷纷驻足会场,与演讲嘉宾深入交流,畅谈大湾区生物医药产业发展大计。 关于JDB电子医药:新药&医疗器械一站式综合服务CRO JDB电子医药科技股份有限公司(简称“JDB电子医药”, 股票代码为300404)创建于2002年,2015年在深圳创业板上市,注册资本金2.61亿元,是一家为国内外医药企业提供药品、医疗器械研发与生产全流程“一站式”外包服务(CRO+CDMO)的新型高新技术企业。公司拥有5.1万平方米的现代化办公、实验和生产场所,目前有超1000名员工,旗下拥有二十多家全资、控股子公司以及十余家关联业务的参股公司;目前获得中国医药外包公司10强、广州市科技小巨人企业、广东省诚信示范企业、广州市著名商标、中国最具投资价值企业50强、中国医药质量管理协会CRO分会会长单位等荣誉称号;是国内仅有的两家全流程服务CRO之一,也是以临床试验为主要业务的CRO上市公司之一。 JDB电子医药“一站式”服务包括:新药立项研究和活性筛选、药学研究(原料、制剂)、药物评价(药效学、毒理学)、小分子创新药一体化服务、临床研究、中美双报(注册服务)、CDMO生产(MAH落地)、技术成果转化等,涵盖了新药研发各个阶段。
2022-06-02
今天(5月11日),E10B项目Ⅰ期临床试验启动会以线上形式在广州、蚌埠两地同时举行。E10B是由广州达博生物制品有限公司开发的治疗用生物制品1类新药,蚌埠医学院第一附属医院泌尿外科主任薛胜和机构主任周焕担任该项目PI,JDB电子医药为该项目提供Ⅰ期临床研究服务。 蚌埠医学院第一附属医院泌尿外科主任薛胜、机构主任周焕、广州达博生物制品有限公司董事长黄文林、副总经理田烁、JDB电子医药I期临床运营部项目经理黄梦圆等有关人员参与此次会议。会议伊始,薛胜代表临床试验机构发表讲话。他表示,E10B项目是一款利用基因治疗技术研发的抗肿瘤新药,在临床前研究中展现出了良好的安全性和有效性,具有良好的临床应用前景,有望成为抗肿瘤治疗药物的新选择,经过前期多轮会议探讨,目前已对研究的整体策划、临床试验方案等板块进行了充分论证,希望在各方的共同努力下,保质保量快速推进该项目的Ⅰ期临床试验,为该项目后续研究打下坚实的基础。 随后,黄梦圆就该项目研究背景、试验方案、试验流程、药物配制、给药操作、给药标准、试验过程中的特别注意事项等进行了汇报,并介绍生物样本预处理注意要点、环境生物安全风险控制计划等,PV专员陈润晴介绍了SAE和SUASR上报要求等。黄文林教授对蚌埠医学院第一附属医院和JDB电子医药的支持和帮助表示感谢,后续将全力支持和配合临床试验方面的各项工作,相信在各方的共同努力下项目将取得理想的成果。随后,与会者在薛胜、周焕两位教授的带领下就入排标准、药物配制、给药操作、受试者管理等问题进行了讨论,并形成了一致意见。JDB电子医药相关负责人表示,E10B项目目前各项准备工作进展顺利,预计首批受试者将于本月内入组。
2022-05-12
